O processo de desenvolvimento de vacinas costuma levar décadas. O longo espaço de tempo decorrido entre a concepção da ideia sobre o novo imunizante e sua distribuição não existe à toa. Todo o ciclo de desenvolvimento exige elevados investimentos financeiros em ciência e tecnologia, captação de pessoal especializado, testes pré-clínicos e clínicos e complexas avaliações regulatórias.
As etapas tradicionais do desenvolvimento de novas vacinas são: fase exploratória inicial, estágio pré-clínico, etapas clínicas, aprovação regulatória, produção, distribuição e controle de qualidade pós-comercialização/distribuição. Cabe ressaltar que o estágio clínico se desdobra em três etapas, as quais se iniciam com a aplicação do imunizante em pequenos grupos e vão até os testes de eficácia e segurança, realizados em larga escala.
A crise sanitária causada pela pandemia da COVID-19 gerou no mundo a demanda por aceleração responsável deste processo. Isto é, o equilíbrio entre o desenvolvimento ágil de uma vacina eficaz contra a COVID-19 e a preservação dos padrões de qualidade necessários à garantia de qualidade e controle da sua produção. Já no início de 2020, governos e companhias farmacêuticas de diversos países aceitaram o desafio e iniciaram as etapas exploratórias e pré-clínicas.
Algumas destas seguiram para os testes clínicos e, em dezembro de 2020, poucas se encontram em fase de produção dos imunizantes. O alcance, em menos de um ano, dos estágios finais do ciclo de desenvolvimento representa um marco na história da humanidade e evidencia o poder imensurável da ciência moderna.
Sabemos que, para além dos aspectos clínicos, a distribuição de imunizantes requer aprovação em procedimentos regulatórios que usualmente se arrastam por longos períodos, dada a complexidade da avaliação da nova tecnologia que será disponibilizada em larga escala à população. É fato que, diante da ameaça da COVID-19, o mundo não dispõe de todo este tempo.
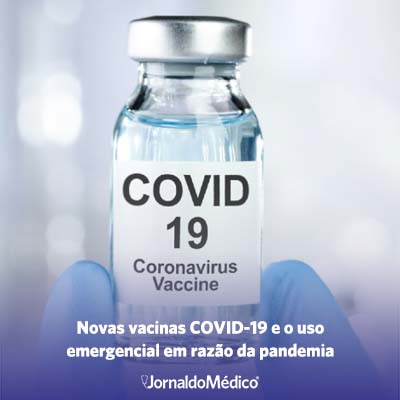
Enquanto diversos países do mundo discutem quando e como realizarão os procedimentos de avaliação regulatória e vigilância pós-distribuição das vacinas contra a COVID-19, o Reino Unido foi a primeira nação a alcançar o estágio de aprovação e, com isso, iniciar a distribuição da vacina produzida pelas farmacêuticas Pfizer e BioNTech. Conforme esperado, a agilidade da etapa de aprovação regulatória se deu em razão da autorização para uso em caráter emergencial, o que permite que a nova vacina seja distribuída sem que todos os testes das etapas clínicas tenham sido concluídos.
Tem-se, então, no Reino Unido, uma autorização temporária de uso. Esta é válida por um ano e mantém a farmacêutica responsável pela produção da vacina obrigada a divulgar resultados dos testes de eficácia e segurança que se mantém em andamento. Uma vez que dados completos sobre o novo imunizante sejam apresentados à agência reguladora do país (The Medicines and Healthcare Products Regulatory Agency), a autorização padrão de comercialização do produto poderá ser concedida às empresas responsáveis.
Posteriormente, os Estados Unidos aprovaram o uso emergencial do mesmo imunizante. Outros países, como Canadá e aqueles que compõem a União Europeia, já receberam solicitações da companhia Pfizer para distribuição da vacina em seus territórios e encontram-se em processo de aprovação.
Seguindo o mesmo processo, o Brasil regulamentou, em 10 de dezembro de 2020, por meio da ANVISA, a possibilidade de farmacêuticas solicitarem à agência a autorização para uso emergencial de vacinas contra COVID-19 no país. Espera-se que, em razão da urgência da crise sanitária, a distribuição emergencial dos imunizantes no país aconteça mediante procedimentos similares aos adotados no Reino Unido, de maneira que a conclusão dos estudos clínicos seja acompanhada pelos órgãos regulatórios nacionais e a vigilância pós-distribuição ocorra em todo o país.
 Autora: Nila Larisse Silva de Albuquerque, Enfermeira. Doutora em Enfermagem.
Autora: Nila Larisse Silva de Albuquerque, Enfermeira. Doutora em Enfermagem.
Contato: larisseufc@hotmail.com
Assine a NewsLetter, receba conteúdos relevantes e a revista digital do Jornal do Médico com conteúdos exclusivos e assinados por especialistas. https://bit.ly/3araYaa
Este post já foi lido207 times!























You must be logged in to post a comment Login